L’Intelligenza Artificiale nella Nutrizione Clinica: opportunità e limiti della trasformazione digitale
L’intelligenza artificiale sta rivoluzionando il modo in cui medici, dietisti e nutrizionisti raccolgono, analizzano e utilizzano i dati alimentari dei pazienti. Dalle applicazioni smartphone che riconoscono il cibo alle piattaforme di supporto decisionale, la tecnologia promette di superare i limiti dei tradizionali diari cartacei e dei questionari di frequenza alimentare. Tuttavia, questa trasformazione non avviene in assenza di vincoli normativi, limitazioni tecniche e responsabilità professionali che il clinico moderno non può ignorare. Il presente articolo analizza il panorama attuale dell’AI nella nutrizione clinica, gli strumenti disponibili e le strategie per implementarli in sicurezza e conformità con la regolamentazione europea.
Alessandro Drago


1. La rivoluzione digitale della valutazione dietetica
1.1 Dai diari cartacei ai sistemi intelligenti di computer vision
Per decenni, il “gold standard” dell’assessment dietetico si è basato su metodi tradizionali: diario alimentare cartaceo, richiamo delle 24 ore (24-hour recall) e questionari di frequenza alimentare (FFQ). Questi strumenti rimangono fondamentali, ma presentano limiti intrinseci noti: dipendenza dalla memoria del paziente, bias di desiderabilità sociale (sottostima del “cibo spazzatura”, sovrastima del “cibo sano”) e alto carico di lavoro per l’analisi manuale dei dati.
Una scoping review del 2025 pubblicata su Frontiers in Nutrition descrive come gli strumenti di valutazione dietetica basati su intelligenza artificiale stiano uscendo dai laboratori di ricerca per entrare nella pratica clinica quotidiana, con applicazioni che combinano computer vision, database nutrizionali e sensori indossabili per stimare l’introito in modo semiautomatico [Phalle & Gokhale 2025]. Altre review confermano che i sistemi basati su immagini e riconoscimento automatico del cibo stanno rapidamente maturando, in particolare per la stima degli apporti energetici e di macronutrienti [Zheng 2024; Chotwanvirat 2024].
Le tecnologie oggi disponibili includono:
applicazioni smartphone che scattano foto al piatto e stimano calorie e nutrienti
sensori indossabili che monitorano masticazione e pattern alimentari
sistemi di monitoraggio passivo che integrano dati da wearable e app
algoritmi di machine learning che apprendono dai pattern individuali di assunzione
1.2 Benefici clinici, precision nutrition e popolazioni target
Le applicazioni più promettenti riguardano la gestione delle patologie croniche. Nella scoping review di Phalle e Gokhale, diverse sperimentazioni mostrano l’utilità dei diari digitali AI-assistiti in pazienti con obesità e diabete di tipo 2, dove il monitoraggio di carboidrati, apporto energetico e abitudini alimentari può tradursi in aggiustamenti terapeutici più precisi [Phalle & Gokhale 2025]. In ambito di precision nutrition, un’ampia revisione evidenzia come l’AI consenta di integrare dati dietetici, metabolici e genetici per personalizzare gli interventi nutrizionali, pur sottolineando la necessità di studi clinici solidi [Wu 2025].
Tra le popolazioni target spiccano:
pazienti con malattie metaboliche croniche (diabete tipo 2, obesità)
anziani fragili a rischio di malnutrizione silente
soggetti coinvolti in programmi di nutrizione personalizzata ad alta intensità di dati
La promessa non è solo “più dati”, ma dati più granulari e meno gravosi da registrare per pazienti e clinici.
2. Limiti attuali e sfide tecniche
2.1 Eterogeneità dei database e accuratezza
Revisioni critiche evidenziano che, se da un lato la computer vision applicata al cibo ha compiuto progressi notevoli, dall’altro persistono importanti limiti metodologici [Shonkoff 2022; Chotwanvirat 2024]. In particolare:
forte variabilità tra database nutrizionali utilizzati dagli algoritmi
differenze nella definizione e codifica degli alimenti
scarsa trasparenza sulle metriche di accuratezza in contesti real-world
Una scoping review dedicata alle applicazioni AI per misurare introiti di alimenti e nutrienti conferma che, pur essendo promettenti, molti sistemi sono stati testati in campioni limitati o in condizioni controllate, con poche validazioni contro metodi di riferimento come l’acqua doppiamente marcata [Zheng 2024].
L’errore medio nella stima calorica può ancora essere rilevante per singolo pasto, soprattutto per piatti composti, condimenti o alimenti processati. Per questo, il ruolo del dietista nell’interpretare criticamente l’output algoritmico resta centrale.
2.2 Rappresentatività culturale e inclusività
Un problema emergente riguarda la scarsa rappresentatività delle cucine non occidentali nei dataset utilizzati per addestrare i modelli. Le review mettono in evidenza come la maggior parte degli algoritmi sia stata sviluppata e validata su alimenti e porzioni tipiche di contesti nordamericani o europei [Phalle & Gokhale 2025; Sosa-Holwerda 2024]. Questo può tradursi in:
errori di riconoscimento per piatti tradizionali o etnici
sottostima o sovrastima sistematica delle porzioni
minore accuratezza per popolazioni con pattern alimentari diversi
La questione non è solo tecnica, ma di equità: se gli strumenti AI funzionano meglio su alcune culture alimentari rispetto ad altre, si rischia di amplificare disparità preesistenti.
2.3 Dati migliori, outcome clinici ancora da dimostrare
Le review più ampie sul ruolo dell’AI nella ricerca in nutrizione e nelle evidenze su food e salute mostrano un quadro chiaro: l’AI migliora la capacità di raccogliere, integrare e analizzare dati, ma il collegamento diretto con outcome clinici duri (controllo glicemico, peso a lungo termine, eventi cardiovascolari) è ancora poco documentato [Bailey 2024; Sosa-Holwerda 2024]. Molti studi si fermano a endpoint intermedi (es. qualità dei dati, aderenza alla registrazione, soddisfazione degli utenti) e non dimostrano ancora un vantaggio netto sugli esiti di salute.
3. L’AI nel supporto decisionale: dai LLM ai sistemi di raccomandazione
3.1 Large Language Model (LLM) e AI Act
Con l’entrata in vigore dell’AI Act europeo (Regolamento UE 2024/1689), i sistemi AI destinati alla gestione e cura dei pazienti, inclusi software di supporto decisionale clinico e LLM integrati in contesti sanitari — sono classificati come “ad alto rischio” [Reg. UE 2024/1689]. Questo implica:
sistemi di gestione della qualità e valutazione del rischio
requisiti di trasparenza e tracciabilità
supervisione umana continua (human-in-the-loop)
documentazione tecnica verificabile dalle autorità
I Large Language Model sono già utilizzati per:
sintetizzare cartelle cliniche e referti lunghi
tradurre linguaggio tecnico in spiegazioni accessibili per i pazienti
generare materiale educativo personalizzato su dieta e stile di vita
3.2 Allucinazioni, bias e AI literacy
Una revisione su eClinicalMedicine dedicata alla formazione in AI per clinici introduce il concetto di AI literacy, sottolineando come l’uso sicuro dei LLM richieda nuove competenze: interpretazione probabilistica delle risposte, riconoscimento dei bias e capacità di valutare la plausibilità clinica degli output [Schubert 2024]. Altri lavori evidenziano che il gap tra diffusione commerciale di chatbot avanzati e capacità dei professionisti di valutarli criticamente è ancora ampio [Garvey 2021; Pupic 2023].
Tra i rischi principali:
allucinazioni: generazione di contenuti falsi ma plausibili (es. linee guida inesistenti, protocolli non validati) [Schubert 2024]
bias di addestramento: sottorappresentazione di determinate popolazioni, linee guida non aggiornate, dati di origine non trasparente [Bailey 2024]
In questo contesto, raccomandazioni per piani dietetici o protocolli di integrazione suggerite da un LLM devono essere sempre verificate rispetto alle linee guida evidence-based e al quadro clinico del singolo paziente [Labkoff 2024].
3.3 Model cards, CDS e responsabilità professionale
Per favorire un uso responsabile dell’AI in sanità, vengono proposte model cards e etichette di sistema che esplicitino popolazioni di validazione, fonti dei dati, contesti d’uso appropriati e limiti noti [Labkoff 2024; Schubert 2024]. I documenti di consenso sui sistemi di supporto decisionale (CDS) insistono su:
· spiegabilità: il clinico deve poter comprendere le basi di una raccomandazione
· override: il professionista deve poter ignorare o modificare suggerimenti non coerenti con il caso [Labkoff 2024]
La responsabilità finale per la prescrizione nutrizionale o l’indicazione di integratori rimane in capo al professionista, non al fornitore del software o al modello.
4. Integratori alimentari e AI: claim, sorveglianza e fattore umano
4.1 Un mercato ad alto rischio di disinformazione
Lo studio di Muela-Molina e colleghi su 437 spot radiofonici di integratori in Spagna ha rilevato che oltre l’80% dei claim di funzione non era conforme al quadro regolatorio europeo, con affermazioni fuorvianti o prive di autorizzazione [Muela-Molina 2021]. In un mercato caratterizzato da forte pressione commerciale, l’uso di AI generativa per creare contenuti di marketing o “piani personalizzati” può amplificare la disinformazione, se non controllato.
4.2 L’AI come strumento di sorveglianza EFSA
L’EFSA ha avviato una roadmap sull’uso dell’AI (AI@EFSA) per potenziare la sorveglianza su sicurezza alimentare e comunicazione, esplorando in particolare:
NLP per analizzare grandi volumi di testi web e social media
strumenti AI per identificare pattern di claim sospetti
soluzioni per estrarre e integrare dati da nuove metodologie (NAMs) [EFSA 2024a; EFSA 2024b; EFSA 2024c]
La stessa tecnologia che può generare contenuti fuorvianti può essere usata dalle autorità per individuarli e contrastarli.
4.3 Raccomandazioni di integratori e protocolli human-in-the-loop
In ambito clinico, l’AI può supportare la valutazione dei fabbisogni di micronutrienti, la previsione di interazioni nutriente-farmaco e la priorità di monitoraggio in pazienti complessi [Atwal 2024]. Tuttavia, la letteratura concorda su un punto: la decisione di prescrivere un integratore, scegliere dosaggi e durata, resta un atto medico, da collocare in un protocollo human-in-the-loop:
l’algoritmo propone, sulla base di dati e modelli
il professionista valuta, integra e, se necessario, modifica
la responsabilità clinica finale resta umana [Labkoff 2024; Atwal 2024]
Per i pazienti, è essenziale non confondere app di wellness e sistemi di raccomandazione generica con dispositivi medici certificati.
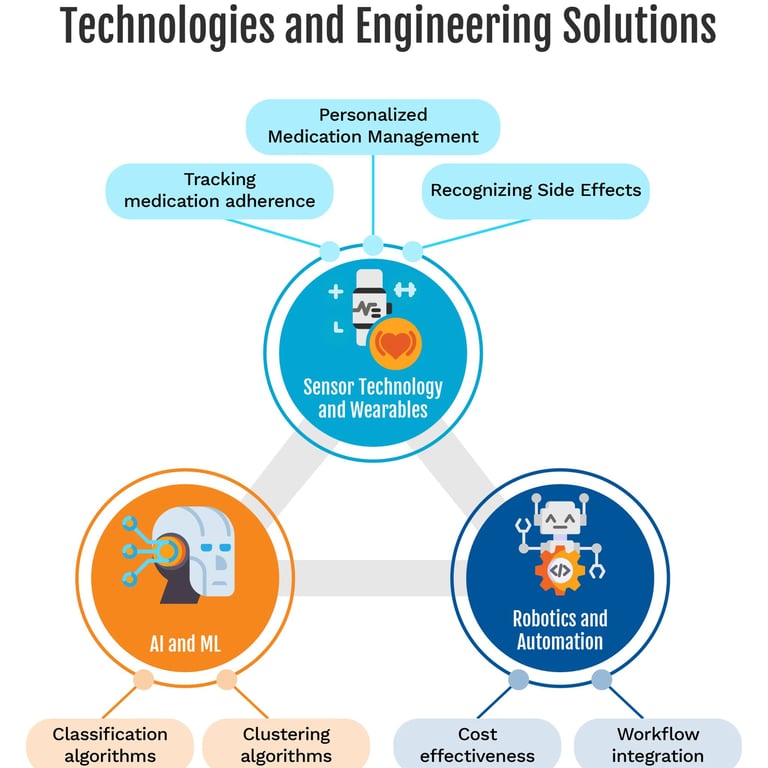
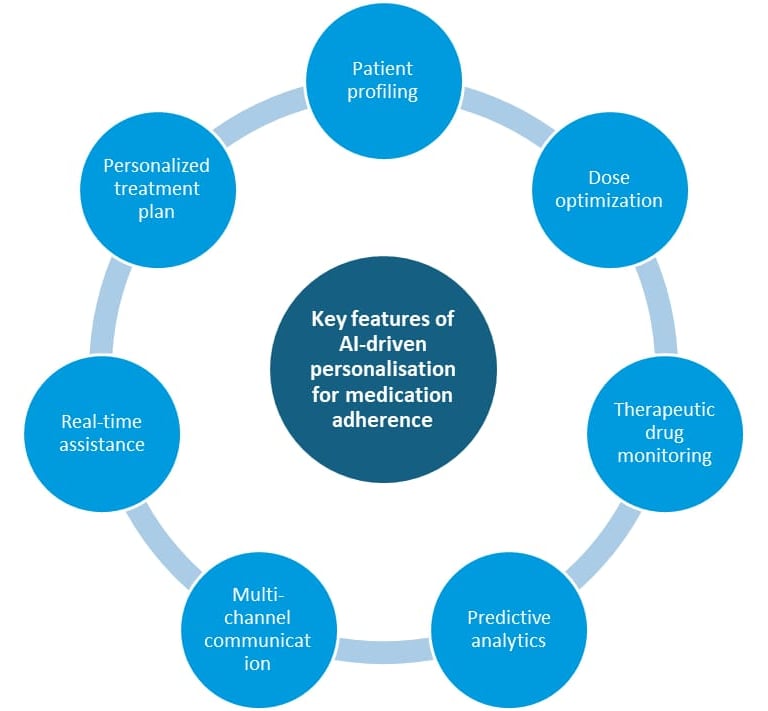
5. Aderenza a terapie e integratori: cosa può fare il machine learning
5.1 Perché l’aderenza è cruciale
La scarsa aderenza terapeutica è una delle principali cause di insuccesso nelle terapie per malattie croniche. Impatta negativamente su outcome clinici, qualità di vita e costi sanitari. Diversi studi hanno esplorato l’uso di AI per:
monitorare l’assunzione di farmaci
predire il rischio di non aderenza
personalizzare interventi di supporto [Babel 2021; Bohlmann 2021; Rhudy 2025; Zavaleta-Monestel 2025]
5.2 Strumenti digitali per supportare l’aderenza
Le applicazioni documentate includono:
promemoria intelligenti che si adattano agli orari e alle abitudini del paziente
soluzioni di Directly Observed Therapy digitale, basate su computer vision, per confermare l’assunzione del farmaco
analisi passiva di dati da sensori e smartphone per individuare pattern di non aderenza
chatbot e app che offrono coaching motivazionale e risposte a dubbi quotidiani [Babel 2021; Bohlmann 2021]
Una review aggiornata mostra che, complessivamente, questi strumenti tendono a migliorare l’aderenza rispetto alla cura standard, pur evidenziando grande eterogeneità nei metodi di misurazione e nella definizione stessa di aderenza [Zavaleta-Monestel 2025].
5.3 Modelli predittivi e stratificazione del rischio
Le review sulle applicazioni del machine learning alla predizione della non aderenza evidenziano buone performance di modelli come random forest e gradient boosting, soprattutto quando integrano dati clinici, socio-demografici e comportamentali [Rhudy 2025]. In uno studio specifico, uno strumento basato su un breve questionario a 5 item ha permesso di classificare i pazienti in tre cluster di rischio (basso, moderato, alto) con un’accuratezza del 70% e un valore predittivo negativo del 93%, particolarmente utile per individuare chi difficilmente sarà non aderente [Korb-Savoldelli 2023].
5.4 Applicazione al mondo degli integratori
Nel contesto degli integratori, non esistono ancora molte revisioni sistemiche dedicate, ma i principi generali sono trasferibili quando:
l’integrazione è parte di un piano terapeutico evidence-based
una scarsa aderenza comporta rischi (es. deficit documentati, condizioni carenziali)
Rimane fondamentale che l’AI sia impiegata per supportare l’aderenza a terapie appropriate, non per promuovere l’uso continuativo di prodotti di dubbia utilità.
6. Governance, etica e ruolo del professionista
6.1 Questioni aperte
L’uso esteso dell’AI in nutrizione clinica solleva domande di governance ed etica:
chi risponde per un errore algoritmico che porta a malnutrizione o eccessi?
come garantire database inclusivi rispetto alle diverse culture alimentari?
come evitare che i bias nei dati si traducano in raccomandazioni discriminatorie?
6.2 Verso standard comuni e trasparenza
Per affrontare questi nodi, si stanno sviluppando:
model cards per documentare ambito di validità e limiti degli algoritmi [Schubert 2024]
linee guida per la conduzione e il reporting di trial clinici con componenti AI
registri di strumenti AI utilizzati in ambito sanitario, con informazioni su performance e rischi [Labkoff 2024]
6.3 L’AI come “terzo occhio”, non pilota automatico
Il messaggio chiave è che l’AI non sostituisce la relazione terapeutica, ma può renderla più data-driven. Per il professionista i sistemi AI sono un “terzo occhio” sul dato, non una scorciatoia decisionale; gli output vanno sempre verificati, criticati e integrati nel contesto clinico paziente e clinico devono poter discutere con trasparenza limiti e benefici degli strumenti utilizzati

#NutriAI #NutriAINewsletter #IntelligenzaArtificiale #AI #Nutrizione #ComunicazioneScientifica #FoodTech #SicurezzaAlimentare #RegolamentoAI #EFSA #ConformitàNormativa #ISO42001 #HealthClaims #InnovazioneDigitale #AIResponsabile #TrasparenzaAI #Governance #DataScience #ComplianceAlimentare #NutrizioneDigitale #FoodLaw #RischioAltoAI #TrustInAI #AINews #ScientificCommunication #EUAIAct #MedicalEducation #AIliteracy #ContinuingEducation #Dietitians #Nutritionists #LargeLanguageModels #AIAct #ClinicalDecisionSupport #DigitalHealth #Nutrition
Disclaimer: Tutti i diritti delle immagini e contenuti utilizzati appartengono ai rispettivi proprietari. Questo articolo è fornito a scopo educativo e informativo. Non costituisce consulenza legale o normativa. Le organizzazioni dovrebbero consultare esperti legali e normativi qualificati prima di implementare sistemi di IA nel settore nutrizionale.
--------------------------------------------------------------------------
Riferimenti Bibliografici e Normativi
Atwal K. Artificial intelligence in clinical nutrition and dietetics: A brief overview of current evidence. Nutr Clin Pract. 2024;39(4):736–742.
Bailey RL et al. Artificial intelligence in food and nutrition evidence: The challenges and opportunities. PNAS Nexus. 2024;3(12):pgae461.
Babel A et al. Artificial Intelligence Solutions to Increase Medication Adherence in Patients With Non-communicable Diseases. Front Digit Health. 2021;3:669869.
Bohlmann A et al. Machine Learning and Medication Adherence: Scoping Review. JMIRx Med. 2021;2(4):e26993.
EFSA. AI@EFSA: Roadmap for action on Artificial Intelligence. EFSA Supporting Publications, 2024.
Garvey KV et al. The Gap in AI-Related Clinical Competencies and the Need to Close It. Med Sci Educ. 2021;31(6):2055–2060.
Korb-Savoldelli V et al. Machine learning–based patient-reported outcome measure on medication adherence. J Med Internet Res. 2023;25:e42384.
Labkoff S et al. Toward a responsible future: recommendations for AI-enabled clinical decision support. J Am Med Inform Assoc. 2024;31(11):2730–2739.
Muela-Molina C et al. False and misleading health-related claims in food supplements on Spanish radio. Public Health Nutr. 2021;24(15):5156–5165.
Phalle A, Gokhale D. AI-assisted dietary assessment tools—a scoping review. Front Nutr. 2025;12:1518466.
Rhudy C et al. Machine learning approaches to predicting medication nonadherence: a scoping review. Int J Med Inform. 2025;204:106082.
Schubert T et al. AI education for clinicians. eClinicalMedicine. 2024;79:102968.
Shonkoff E et al. AI-Based Dietary Assessment Methods Using Digital Images. Curr Dev Nutr. 2022;6(Suppl 1):534.
Wu X et al. A Scoping Review of Artificial Intelligence for Precision Nutrition. Adv Nutr. 2025;16(4):100398.
Zavaleta-Monestel E et al. AI Tools That Improve Medication Adherence. Cureus. 2025;17(4):e83132.
Zheng J et al. AI Applications to Measure Food and Nutrient Intakes: Scoping Review. J Med Internet Res. 2024;26:e54557.
Contatti
Seguimi su LinkedIn
Nutri-AI 2025 - Alessandro Drago. Tutti i diritti sono riservati
e-mail: info@nutri-ai.net